马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
子宫内膜癌指南
目录
________________________________________
子宫肿瘤的初始评估(UN-1)
脚注:
a.用于确诊或疑似恶性病变患者的初始术前评估。
b.术前影像学检查和活检可能有助于识别子宫肉瘤,虽然活检对于子宫肉瘤的灵敏性不如子宫内膜癌。如果疑似恶性间叶肉瘤,应避免分裂/分碎。
c.参见子宫内膜癌的病理学检查原则(ENDO-A)和子宫肉瘤的病理学检查原则(UTSARC-A)。
d.参见子宫内膜癌的影像学检查原则(ENDO-A)和子宫肉瘤的影像学检查原则(UTSARC-A)。
e.应按高级别子宫内膜癌进行治疗。
f.也称作恶性中胚叶混合瘤或恶性苗勒氏混合瘤,包括含有同源或异源基质成分的那些肿瘤。
________________________________________
子宫内膜癌
局限于子宫(ENDO-1)
脚注:
a.关于子宫肿瘤的说明,请参见UN-1。
b.见病理学检查和分子学分析原则(ENDO-A)。
c.如果技术条件可行,首选微创手术(MIS)治疗。见评估和手术分期原则(ENDO-C)。
d.用于评估疾病状态的手术分期的程度取决于术前及术中所见。推荐多学科团队会诊。见评估和手术分期原则(ENDO-C)。
e.对于一些经过筛选的卵巢外观正常且没有乳腺癌/卵巢癌或林奇综合征家族史的早期绝经前子宫内膜样癌妇女,保留卵巢可能是安全的。推荐行输卵管切除术。
f.见子宫肿瘤的放射治疗原则(UN-A)。
g.见复发、转移或高风险疾病的系统性治疗(ENDO-D)。
________________________________________
疑似或肉眼可见宫颈受侵(ENDO-2)
脚注:
a.关于子宫肿瘤的说明,请参见UN-1。
b.见病理学检查和分子学分析原则(ENDO-A)。
d.用于评估疾病状态的手术分期的程度取决于术前及术中所见。推荐多学科团队会诊。见评估和手术分期原则(ENDO-C)。
f.见子宫肿瘤的放射治疗原则(UN-A)。
g.见复发、转移或高风险疾病的系统性治疗(ENDO-D)。
h.见影像学检查原则(ENDO-B)。
i.清楚显示宫颈基质受侵。
________________________________________
疑似子宫外侵犯(ENDO-3,4,5,6)
ENDO-3
附加检查和初始治疗
脚注:
a.关于子宫肿瘤的说明,请参见UN-1。
b.见病理学检查和分子学分析原则(ENDO-A)。
d.用于评估疾病状态的手术分期的程度取决于术前及术中所见。推荐多学科团队会诊。见评估和手术分期原则(ENDO-C)。
f.见子宫肿瘤的放射治疗原则(UN-A)。
g.见复发、转移或高风险疾病的系统性治疗(ENDO-D)。
h.见影像学检查原则(ENDO-B)。
j.对于转移灶数目为1-5个的子宫内膜癌患者,如果行子宫切除术,则考虑对转移灶行消融性放疗(2B类证据)。
k.手术的目标是无残留可测量的病灶。
ENDO-4
I期患者的辅助治疗
脚注:
a.关于子宫肿瘤的说明,请参见UN-1。
d.用于评估疾病状态的手术分期的程度取决于术前及术中所见。推荐多学科团队会诊。见评估和手术分期原则(ENDO-C)。
f.见子宫肿瘤的放射治疗原则(UN-A)。
g.见复发、转移或高风险疾病的系统性治疗(ENDO-D)。
l.一旦阴道残端愈合即开始行放疗,最好不迟于术后12周。
m.如果存在2个危险因素,强烈建议行经阴道近距离放射治疗。
n.如果HIR组按照GOG 249试验中定义:年龄为50-69岁伴有2个危险因素、或者年龄<50岁伴有3个危险因素、或者年龄≥18岁伴有3个危险因素。危险因素包括:2级或3级、深度浸润至外半部、以及LVSI。
o.潜在的不良危险因素:年龄≥60岁、侵犯深度、和/或淋巴脉管浸润(LVSI)。有关不良危险因素的更多信息,请参见讨论部分。
p.需要行“EBRT±系统性治疗”的危险因素包括:年龄、LVSI和肌层浸润深度。危险因素是连续变量。年龄越大(特别是> 60岁)、LVSI越广泛、肌层浸润越深(> 50%),复发风险更高。此外,当存在的风险因素越多时,复发风险也越高。参见复发、转移或高风险疾病的系统性治疗(ENDO-D)。
ENDO-5
II期患者的辅助治疗
脚注:
a.关于子宫肿瘤的说明,请参见UN-1。
d.用于评估疾病状态的手术分期的程度取决于术前及术中所见。推荐多学科团队会诊。见评估和手术分期原则(ENDO-C)。
f.见子宫肿瘤的放射治疗原则(UN-A)。
g.见复发、转移或高风险疾病的系统性治疗(ENDO-D)。
l.一旦阴道残端愈合即开始行放疗,最好不迟于术后12周。
q.如果先前没有做过,考虑附加行影像学检查。见影像学检查原则(ENDO-B)。
r.不良宫颈危险因素包括:间质浸润深度、级别、LVSI,影响I期疾病治疗决策的不良危险因素(参见ENDO-4,如肌层浸润深度和LVSI)也可能影响II期疾病的辅助治疗选择。
s.经阴道近距离放射疗法对于手术分期为阴性或微浸润的低级别疾病也是一种选择。对于那些进行根治性子宫切除术且手术切缘为阴性的患者,观察是一种选择方案。
ENDO-6
III、IV期患者的辅助治疗
脚注:
a.关于子宫肿瘤的说明,请参见UN-1。
d.用于评估疾病状态的手术分期的程度取决于术前及术中所见。推荐多学科团队会诊。见评估和手术分期原则(ENDO-C)。
f.见子宫肿瘤的放射治疗原则(UN-A)。
g.见复发、转移或高风险疾病的系统性治疗(ENDO-D)。
t.如果先前没有做过,考虑附加行影像学检查。见影像学检查原则(ENDO-B)。
u.这些指南是基于试验的结果,试验中放化疗是同步进行而不是序贯进行。
v.联合治疗共同取决于局部区域和远处转移风险的评估。对于IIIC期疾病,首选联合治疗。
________________________________________
手术分期不全面(ENDO-7)
脚注:
d.用于评估疾病状态的手术分期的程度取决于术前及术中所见。推荐多学科团队会诊。见评估和手术分期原则(ENDO-C)。
f.见子宫肿瘤的放射治疗原则(UN-A)。
h.见影像学检查原则(ENDO-B)。
________________________________________
适合考虑保留生育功能治疗选择的标准(ENDO-8)
脚注:
c.如果技术条件可行,首选微创手术(MIS)治疗。见评估和手术分期原则(ENDO-C)。
d.用于评估疾病状态的手术分期的程度取决于术前及术中所见。推荐多学科团队会诊。见评估和手术分期原则(ENDO-C)。
h.见影像学检查原则(ENDO-B)。
w.参见《 NCCN癌症生存者指南》中的“健康生活方式(HL-1)”和“营养与体重管理(SNWM-1)”。
x.Gunderson CC, Fader AN, Carson KA, Bristow RE. Oncologic and reproductive outcomes with progestin therapy in women with endometrial hyperplasia and grade 1 adenocarcinoma: a systematic review. 2012 Gynecol Oncol;125:477-482 and Hubbs JL, Saig RM, Abaid LN, et al. Systemic and local hormone therapy for endometrial hyperplasia and early adenocarcinoma. Obstet Gynecol 2013;121:1172-1180.
y.如果患者不是处于积极受孕的过程,推荐每6 个月行一次子宫内膜取样和接受以孕激素为基础的治疗。
________________________________________
监测(ENDO-9)
脚注:
f.见子宫肿瘤的放射治疗原则(UN-A)。
g.见复发、转移或高风险疾病的系统性治疗(ENDO-D)。
h.见影像学检查原则(ENDO-B)。
z.如果原发灶已经得到控制,对于转移灶数目为1-5个的患者考虑行消融性放疗(2B类证据)。(Palma DA, Olson R, Harrow S, et al. Stereotactic radiotherapy versus standard of care palliative treatment in patients with oligometastatic cancers (SABR-COMET): a randomised, phase 2, open-label trial. Lancet 2019;393:2051-2058.)
________________________________________
局部区域复发(ENDO-10)
脚注:
f.见子宫肿瘤的放射治疗原则(UN-A)。
g.见复发、转移或高风险疾病的系统性治疗(ENDO-D)。
h.见影像学检查原则(ENDO-B)。
aa.可能包括伴孤立的髂总淋巴结或腹主动脉旁淋巴结复发的患者。
bb.考虑对一些选择性患者行术前外照射放疗(EBRT)。
cc.建议用于小体积的阴道和/或阴道旁病灶。
dd.考虑对含阴道成分的局部区域病灶行近距离放射治疗。
ee.对先前未接受过放疗的患者或被认为可耐受额外放疗的患者,可考虑在切除术后行巩固性外照射放疗。
________________________________________
组织学类型为高风险的癌(ENDO-11)
脚注:
c.如果技术条件可行,首选微创手术(MIS)治疗。见评估和手术分期原则(ENDO-C)。
d.用于评估疾病状态的手术分期的程度取决于术前及术中所见。推荐多学科团队会诊。见评估和手术分期原则(ENDO-C)。
f.见子宫肿瘤的放射治疗原则(UN-A)。
g.见复发、转移或高风险疾病的系统性治疗(ENDO-D)。
h.见影像学检查原则(ENDO-B)。
ff.也被称作恶性中胚叶混合瘤或恶性苗勒氏混合瘤。
gg.观察仅适用于子宫切除标本中无残留浆液性癌或透明细胞癌的选择性患者。
病理学检查和分子学分析原则(ENDO-A)
ENDO-A,1/4
病理学检查原则a,1,2,3
手术方式:
●TH/BSO:全子宫切除术+双侧输卵管-卵巢切除术
●RH:根治性子宫切除术
癌的病理学评估(包括癌、癌肉瘤和神经内分泌癌):
●子宫
►子宫切除术类型
►标本完整性(完整、切开、破碎、其它)
►肿瘤部位(子宫内膜、子宫下段、息肉)
►肿瘤大小
►组织学类型
►组织学级别
►肌层浸润(浸润深度/肌层厚度,以mm为单位)
►宫颈间质受累b
►淋巴脉管间隙浸润 (LVSI)c
●其它组织/器官受累(输卵管、卵巢、阴道、宫旁、腹膜、网膜、其它)
●腹膜/腹水细胞学检查d
●淋巴结(当切除时)
►前哨淋巴结需进行超分期以检测小体积的转移灶。e
►孤立肿瘤细胞分期为N0(i+),虽不会提高分期,但在讨论辅助治疗时应当考虑。
►淋巴结转移的水平(如盆腔、髂总及腹主动脉旁)。
►孤立肿瘤细胞转移、微转移及肉眼转移的淋巴结数目。
►建议对前哨淋巴结组织标本细致地进行肉眼评估,以确保标本中包含淋巴结组织。评估可以由术者来完成(取决于肉眼评估的经验水平/便捷程度)或术中寻求病理会诊。
●建议对III期、IV期和复发患者的组织标本进行雌激素受体检测。
●对于可能接受HER-2靶向治疗的晚期或复发浆液性子宫内膜癌患者,考虑进行HER2免疫组化检测(对于IHC结果模棱两可者,进一步通过FISH法检测HER2)。4
●通过形态学评估来确定子宫内膜癌(尤其是高级别肿瘤)的组织学类型,由于诊断的可重复性存在问题,尚有争议。5,6
脚注:
a.参见评估和手术分期原则(ENDO-C)。
b.放射肿瘤学家可能会要求提供其它信息(包括以mm为单位的浸润深度/以mm为单位的宫颈壁厚度),以帮助EBRT决策。
c.可能要求病理科医生对LVSI进行量化。在I期子宫内膜癌的PORTEC试验患者中,大量的LVSI是影响盆腔区域复发、远处转移和总体生存的一个独立预后因素。Bosse等人使用先前描述的三层评分系统,包括:无(无LVSI)、轻度(在肿瘤周围识别发现单灶性LVSI)或者大量(在肿瘤周围识别发现弥漫或多灶性LVSI)。请注意,轻度LVSI 可能累及多条血管。由6名妇科病理学家组成的专家小组表明,使用这种三层系统对LVSI进行分级具有实质性的可重复性。(ENDO-A,1/4)
d.虽然细胞学检查本身不影响 FIGO 分期,但仍应获取细胞学结果,因为细胞学阳性是一个不良的风险因素。
e.超分期通常需要对大体的前哨淋巴结进行连续薄切片,并对前哨淋巴结的所有样本块进行多个切片H&E染色检查±细胞角蛋白免疫组化检查。没有用于淋巴结超分期的标准方案。
ENDO-A,2/4
分子学分析原则
●根据不同的临床预后将子宫内膜癌分为4种分子亚型,包括POLE突变型、高水平微卫星不稳定型(MSI-H)、低拷贝型及高拷贝型。10
●鼓励额外进行POLE突变、错配修复(MMR)/微卫星不稳定(MSI)、及p53异常表达的检测,可对肿瘤组织分型的形态学评估进行补充。11见图1:子宫内膜癌的病理和基因组(ENDO-A,3/4)。
●推荐对子宫内膜癌广泛进行MMR蛋白/MSI检测。
►检测可以在初始活检或D&C材料或最终的子宫切除标本上进行。
►应进一步评估启动子甲基化对MLH1丢失的影响,以评估表观遗传过程。
►建议进行遗传咨询、分子学分析和所有其它MMR异常检测。
►对于那些MMR完整/MSI稳定、或尚未进行基因筛查但有子宫内膜癌和(或)结直肠癌强家族史的患者,建议进行遗传咨询和基因检测。(参见《NCCN遗传/家族性高风险评估指南:结直肠癌》中的“林奇综合征/HNPCC”章节)
●对于转移性或复发性子宫内膜癌患者,考虑行NTRK基因融合检测。
ENDO-A,3/4
子宫内膜癌的病理和基因组
图1:子宫内膜癌的病理和基因组f,g
脚注:
f.经许可转载自Murali R, Delair DF, Bean SM, et al. Evolving roles of histologic evaluation and molecular/genomic profiling in the management of endometrial cancer. J Nat Compr Canc Netw 2018;16:201-209。
g.子宫内膜癌基因组-病理综合分类的诊断流程(蓝色代表组织型;红色代表TCGA基因组类别)。
h.也可能适用于透明细胞癌。
i.该流程无法区分TP53突变拷贝数高的肿瘤(即,高级别子宫内膜样癌、浆液性癌和透明细胞癌)的组织学类型。
ENDO-A,4/4
参考文献
________________________________________
子宫内膜癌的影像检查原则a,1-9(ENDO-B)
ENDO-B,1/2
影像检查原则
初始检查
●接受不保留生育功能的治疗
►考虑行胸部成像(胸部X线摄片)。如果发现异常,接着可能行胸部CT平扫。
►考虑行盆腔MRI检查以明确肿瘤的原发部位(宫颈内Vs子宫内膜)并评估局部病灶的范围。
►对于高级别癌b,考虑行胸部/腹部/盆腔CT以评估远处转移。
►对于接受全子宫切除术后偶然发现子宫内膜癌或分期不全面伴子宫危险因素 c 的患者,考虑行胸部/腹部/盆腔CT以评估远处转移。
►在一些选择性患者中,如果疑似存在转移,考虑行全身PET/CT检查。
►其它初始影像学检查应基于症候学和临床对远处转移的担心情况。d
●接受保留生育功能的治疗
►行盆腔MRI检查(首选)以排除肌层浸润并评估局部病变的范围;如果存在MRI检查禁忌,则行经阴道盆腔超声检查。
►考虑行胸部成像(胸部X线摄片)。如果发现异常,接着可能行胸部CT平扫。
►在一些选择性患者中,如果疑似存在转移,考虑行全身PET/CT检查。
►其它初始影像学检查应基于症候学和临床对远处转移的担心情况。e
随访/监测
●接受不保留生育功能的治疗
►应根据患者的症状、风险评估和临床对复发或远处转移的担心情况来指导影像学检查。e
●接受保留生育功能的治疗
►对于接受药物治疗6个月后失败而子宫内膜癌持续存在的患者(尤其是考虑进一步采取保留生育功能治疗手段的患者),复查盆腔MRI(首选)。
►其它初始影像学检查应基于症候学和临床对远处转移的担心情况。e
疑似复发或转移
●基于症状和体检的结果行腹部/盆腔和/或胸部CT。e
●根据临床指征对于一些选择性患者,考虑行全身PET-CT和/或腹部/盆腔MRI。
脚注:
a.除非存在禁忌症,指南中提及的MRI和CT都要加增强扫描。筛查性胸部CT不需要加增强扫描。
b.高级别子宫内膜癌包括:低分化子宫内膜癌、浆液性癌、透明细胞癌、未分化癌和癌肉瘤。
c.全子宫切除术后确认的子宫风险因素包括:高级别癌(上述标准)、肌层浸润>50%、宫颈间质受侵、淋巴脉管间隙浸润(LVI)、肿瘤>2cm。
d.指征可能包括体检发现异常、巨块性子宫肿瘤、阴道或宫外受侵、发现或治疗晚、存在腹部或肺部症状。
e.指征可能包括体检发现异常(如发现阴道肿瘤)、触及肿块或增大的淋巴结、新发的盆腔、腹部或肺部症状。
ENDO-B,2/2
参考文献
________________________________________
评估和手术分期原则(ENDO-C)
EDNO-C,1/6
子宫内膜癌的手术分期原则
子宫内膜癌的手术分期原则1-15
●除非患者渴望(并适合)选择保留生育能力的治疗(见 ENDO-8),“全子宫切除术+双侧输卵管卵巢切除术(TH/BSO)+淋巴结评估”是局限于子宫的子宫内膜癌的主要治疗方式。1-3部分经筛选的转移性子宫内膜癌患者也适合行子宫切除术。(参见子宫切除术和病理学评估[ENDO-B])
●子宫内膜癌应该整块切除以争取获得最佳预后;应避免腹腔内子宫分碎或肿瘤破碎。
●尽管局限于子宫的肿瘤的标准术式是微创手术,但“TH/BSO+淋巴结评估”可通过任一手术入路来完成(如腹腔镜、机器人、经阴道、经腹)。随机试验、考克兰系统评价数据库以及基于人群的外科研究均支持在这种情况下首选微创技术手段,因为其手术部位感染率、输血率、静脉血栓栓塞率降低,住院日减少,治疗花费减少,且不损害肿瘤学预后。4-9
●淋巴结评估包括对子宫引流淋巴结群的评估,常包括清扫的盆腔淋巴结±主动脉旁淋巴结。这继续成为局限于子宫的子宫内膜癌妇女手术分期的重要方面,因为该过程提供了可能改变治疗决策的重要的预后信息。
●经常清扫髂外、髂内、闭孔和髂总的盆腔淋巴结以进行分期。
●肠系膜下和肾下区的腹主动脉旁淋巴结评估也可用于高危肿瘤(如深部浸润性病变、高级别组织学类型、浆液性癌、透明细胞癌或癌肉瘤)患者的分期。
●可考虑行前哨淋巴结(SLN)定位。(见ENDO-C,2/6)15
●切除盆腔或腹主动脉区域可疑转移的淋巴结或肿大的淋巴结,对排除淋巴结转移很重要。
●某些患者可能不适合行淋巴结清扫。
●对腹膜、横膈或浆膜表面进行肉眼评估并对任何疑似病变的部位进行活检,对排除宫外病变很重要。
●尽管腹膜细胞学检查并不影响分期,但FIGO和AJCC依然推荐手术医师继续在 TH/BSO术中获取腹膜细胞学检查结果。
●网膜活检通常在组织学为浆液性癌、透明细胞癌或癌肉瘤的患者中施行。
●对于II期患者,应基于术前检查行筋膜外或根治性子宫切除术,以期达到阴性切缘。
EDNO-C,2/6
采用前哨淋巴结显像时的评估和手术分期原则
前哨淋巴结显像用于子宫内膜癌分期的原则10-26
●前瞻性或回顾性研究表明:对于病变明显局限于子宫的妇女中,与系统性淋巴结清扫相比,前哨淋巴结显像结合超分期可能增加淋巴结转移的检出率,且假阴性率较低。10-23,26如果考虑行前哨淋巴结显像,手术医师的专业技术和对技术细节的关注极其关键。近期的证据指示:前哨淋巴结显像也可用于一些高危组织学类型(浆液性癌、透明细胞癌、癌肉瘤)。24,25
●对于恶性病变看似局限于子宫而影像学检查未见转移或术中探查未发现明显宫外病变时,可考虑行前哨淋巴结显像用于手术分期。
●作为一种有效和可验证的技术,宫颈染料注射可用于辨别存在高转移风险的淋巴结(例如,早期子宫内膜癌患者的前哨淋巴结10-12)。
●分别于宫颈浅表(1-3mm)和深部(1-2cm,可选)注射染料,使染料到达宫颈或宫体主要的淋巴管,也即浅表的浆膜下、中间的间质及深部的粘膜下淋巴管。26,27(“ENDO-C,4/6”中的图1)
●宫颈注射能使染料非常好地渗透至子宫血管区域及位于阔韧带内收集宫旁来源的主要子宫淋巴干道,进一步显示盆腔、甚至腹主动脉旁前哨淋巴结。
●子宫体部淋巴管常横跨退化的脐动脉,而盆腔前哨淋巴结最常见于髂外血管的中部、髂内血管的腹侧或闭孔区的上方。(“ENDO-C,4/6”中的图2)
●当淋巴管不再跨过退化的脐动脉,而是沿着输尿管系膜向头侧移动时,可在髂总骶前区发现较少见的前哨淋巴结。(“ENDO-C,4/6”中的图3)
●最常用于宫颈注射的放射性标记物是锝-99m(99mTc);另外也有多种的颜色染料(1%的异硫蓝和1%的甲基蓝 ,2.5%的专利蓝钠盐)。
●靛青绿(IGC)最近被证实是一种有效的显像染料,需要近红外线摄像定位,有非常高的前哨淋巴结检测率,目前常用于很多试验中。20,26,28
●通过提高的病理学超分期技术检测到微小的前哨淋巴结转移灶是手术分期中应用前哨淋巴结显像的另一个潜在价值。10,21-23
●成功的前哨淋巴结显像技术关键在于严格按照前哨淋巴结检测流程,要求在无法显像的病例中切除该侧的淋巴结,及无论显像结果如何,均应切除任何可疑转移或增大的淋巴结。10-12,23,25(ENDO,4/6中的图4)
●对于前哨淋巴结显像失败的病例,可通过术中评估来指导治疗。
EDNO-C,3/6
前哨淋巴结显像用于子宫内膜癌分期的原则(续)
●对前哨淋巴结进行超分期,通常包括2个部分内容:连续切片并观察多张H&E染色切片±细胞角蛋白免疫组织化学染色。
►不同妇科病理科医生之间,连续切片和超分期的方案有所不同。29当采用连续H&E切片和IHC染色时,比较两种不同的子宫内膜癌前哨淋巴结超分期方案,并没有显示出明显的优势差别。30
●最近的数据突出了超分期对于发现小转移灶的潜在重要性。一般而言,前哨淋巴结活检可增加术中的手术精确度以发现更可能藏匿转移的淋巴结以及强化病理方案,从而提高淋巴结转移的检出率,这可能改变分期和辅助治疗的建议。
●应清楚报告存在孤立性肿瘤细胞的淋巴结。在子宫内膜癌中,当检测到孤立性的肿瘤细胞而无宏转移和微转移时,淋巴结分期被命名为 pN0(i+)。30
EDNO-C,4/6
前哨淋巴结显像的注射部位和显像部位示图
注:
a.图1、图2和图3经授权许可转载自纪念斯隆-凯特琳癌症中心(© 2013)。
EDNO-C,5/6
子宫内膜癌SLN手术分期流程图
注:
*经授权许可转载自Barlin JN, Khoury-Collado F, Kim CH, et al. The importance of applying a sentinel lymph node mapping algorithm in endometrial cancer staging: Beyond removal of blue nodes. Gynecol Oncol 2012;125:531-535.
EDNO-C,6/6
参考文献
________________________________________
复发、转移或高风险疾病的系统性治疗(ENDO-D)
ENDO-D,1/2
系统性治疗方案
ENDO-D,2/2
脚注和参考文献
脚注:
a.顺铂、卡铂、脂质体阿霉素、紫杉醇和多西他赛可能引起药物反应。(见《NCCN 卵巢癌指南》中“药物反应的处理[OV-D]”章节)
b.化疗方案可用于所有组织学类型的癌。癌肉瘤目前被视为高级别癌并按照高级别癌治疗。
c.FDA批准的生物类似药适合用于替代曲妥珠单抗。
d.多西他赛可考虑用于存在紫杉醇使用禁忌症的患者。
e.仅用于晚期和复发的肿瘤。
f.“顺铂+多柔吡星+紫杉醇”方案并不被广泛使用,因为担心其毒性。
g.FDA批准的生物类似药适合用于替代贝伐单抗。
h.如果紫杉醇皮试阴性,那么白蛋白结合型紫杉醇是对紫杉醇过敏的患者的合理替代。如果患者对紫杉醇皮试呈阳性,则需要进行紫杉醇脱敏。如果患者的皮试结果呈阳性,白蛋白结合型紫杉醇不能用于替代紫杉醇。
i.贝伐单抗可考虑用于先前接受细胞毒性化疗过程中进展的患者。
j.适用于不适合行根治性手术或放疗并且在先前系统性治疗中进展的不是高水平微卫星不稳定(MSI-H)或错配修复缺陷(dMMR)的晚期或复发性疾病患者。
k.参见《 NCCN免疫治疗相关毒性管理指南》。
l.对于复发性子宫内膜癌,NCCN建议行MSI-H或dMMR检测(如果先前没有做过)。帕博利珠单抗适用于先前接受治疗后进展的MSI-H或dMMR肿瘤患者。
m.激素疗法通常用于较低级别的组织学为子宫内膜样的癌,首选用于小体积的肿瘤或生长速度缓慢的肿瘤。
参考文献:
1.Miller D, Filiaci V, Fleming G, et al. Randomized phase III noninferiority trial of first line chemotherapy for metastatic or recurrent endometrial carcinoma: a Gynecologic Oncology Group study [abstract]. Gynecol Oncol 2012;125:771.
2.Fader AN, Roque DM, Siegel E, et.al. Randomized phase II trial of carboplatin-paclitaxel versus carboplatin-paclitaxel-trastuzumab in uterine serous carcinomas that overexpress human epidermal growth factor receptor 2/neu. J Clin Oncol 2018;36:2044-2051.
3.Homesley HD, Filiaci V, Gibbons SK, et al. A randomized phase III trial in advanced endometrial carcinoma of surgery and volume directed radiation followed by cisplatin and doxorubicin with or without paclitaxel: A Gynecologic Oncology Group study. Gynecol Oncol 2009;112:543-552.
4.Rose PG, Ali S, Moslemi-Kebria M, Simpkins F. Paclitaxel, carboplatin, and bevacizumab in advanced and recurrent endometrial carcinoma. Int J Gynecol Cancer 2017 Mar;27:452-458.
5.Picard M, Pur L, Caiado J, et al. Risk stratification and skin testing to guide re-exposure in taxane-induced hypersensitivity reactions. J Allergy Clin Immunol 2016;137(4):1154-1164.
6.Aghajanian C, Sill MW, Darcy KM, et al. Phase II trial of bevacizumab in recurrent or persistent endometrial cancer: a Gynecologic Oncology Group study. J Clin Oncol 2011;29:2259-2265.
7.Oza AM, Elit L, Tsao MS, et al. Phase II study of temsirolimus in women with recurrent or metastatic endometrial cancer: a trial of the NCIC Clinical Trials Group. J Clin Oncol 2011;29:3278-3285.
8.Makker V, Rasco D, Vogelzang NJ, et al. Lenvatinib plus pembrolizumab in patients with advanced endometrial cancer: an interim analysis of a multicentre, open-label, single-arm, phase 2 trial. Lancet Oncol 2019;20:711-718.
9.Homesley HD, Filiaci V, Markman M, et al. Phase III trial of ifosfamide with or without paclitaxel in advanced uterine carcinosarcoma: a Gynecologic Oncology Group Study. J Clin Oncol 2007;25:526-531.
子宫肉瘤的附加评估和初始治疗(UTSARC-1)
脚注:
a.术前影像学检查和活检可能有助于识别子宫肉瘤,虽然活检对于子宫肉瘤的灵敏性不如子宫内膜癌。如果疑似恶性间叶肉瘤,应避免分裂/分碎。
b.见病理学检查和分子学分析原则(UTSARC-A)。
c.见影像学检查原则(UTSARC-B)。
d.对生育年龄的患者行卵巢切除术应个体化。如果ER/PR阳性,支持行双侧输卵管卵巢切除术(BSO)。
e.对于TH/BSO后偶然发现子宫肉瘤或标本破碎的患者:建议行影像学检查并基于个体情况考虑行附加的手术切除。
f.子宫肉瘤应该整块切除以争取获得最佳预后;应避免分碎。
g.见系统性治疗(UTSARC-C)。
h.见子宫肿瘤的放射治疗原则(UN-A)。
________________________________________
低级别子宫内膜间质肉瘤的附加治疗(UTSARC-2)
脚注:
g.见系统性治疗(UTSARC-C)。
h.见子宫肿瘤的放射治疗原则(UN-A)。
i.见病理学检查和分子学分析原则(UTSARC-A,2/5)。
________________________________________
高级别子宫内膜间质肉瘤、未分化子宫肉瘤和子宫平滑肌肉瘤的附加治疗(UTSARC-3)
脚注:
g.见系统性治疗(UTSARC-C)。
h.见子宫肿瘤的放射治疗原则(UN-A)。
i.见病理学检查和分子学分析原则(UTSARC-A,2/5)。
j.对于一些选择性的获得完全切除、术后影像学检查无残留病灶证据的病例,观察可能是一个选择。
________________________________________
监测和远处转移的治疗(UTSARC-4)
脚注:
c.见影像学检查原则(UTSARC-B)。
g.见系统性治疗(UTSARC-C)。
h.见子宫肿瘤的放射治疗原则(UN-A)。
j.对于一些选择性的获得完全切除、术后影像学检查无残留病灶证据的病例,观察可能是一个选择。
________________________________________
孤立性阴道/盆腔复发的治疗(UTSARC-5)
脚注:
c.见影像学检查原则(UTSARC-B)。
h.见子宫肿瘤的放射治疗原则(UN-A)。
k.如果术前接受过EBRT,术后将不再接受EBRT。
l.对于低级别ESS,系统性治疗的第一选择是抗雌激素激素治疗。参见子宫肉瘤的系统性治疗(UTSARC-C)。
病理学检查和分子学分析原则a,1,2(UTSARC-A)
UTSARC-A,1/5
病理学检查原则
初始检查
手术方式:
●TH/BSO:全子宫切除术+双侧输卵管-卵巢切除术
●RH:根治性子宫切除术
肉瘤的病理学评估(包括平滑肌肉瘤、腺肉瘤、子宫内膜间质肉瘤和未分化肉瘤):
●强烈建议由妇科病理学专家审查
●子宫
►子宫切除术类型
►标本完整性(完整、切开、破碎、其它)
►肿瘤大小
►肌层浸润(仅用于腺肉瘤)
►组织学类型
►组织学级别(仅用于腺肉瘤)
►淋巴脉管间隙浸润 (LVSI)
●其它组织/器官受累(输卵管、卵巢、阴道、宫旁、腹膜、网膜、其它)
●腹膜/腹水细胞学检查b
●淋巴结(当切除时)
►淋巴结转移的水平(如盆腔、髂总及腹主动脉旁)。
►转移淋巴结的数目。
肉瘤的分子学分析
●在许多间叶性恶性肿瘤中,分子谱分析可提供信息用于准确分类
(参见子宫肉瘤:间叶性肿瘤&上皮和间叶混合性肿瘤[UTSARC-A,2/5])
脚注:
a.参见评估和手术分期原则(ENDO-C)。
b.虽然细胞学检查本身不影响 FIGO分期,但仍应获取细胞学结果,因为细胞学阳性是一个不良的风险因素。
参考文献:
1.American College of Obstetricians and Gynecologists. ACOG practice bulletin, clinical management guidelines for obstetrician-gynecologists, number 65, August 2005:management of endometrial cancer. Obstet Gynecol 2005;106:413-425.
2.Krishnamurti U, Movahedi-Lankarani S, Bell DA, et al. Protocol for the examination of specimens from patients with primary sarcoma of the uterus. College of American Pathologists 2018.
UTSARC-A,2/5
表1
UTSARC-A,3/5
表1(续)
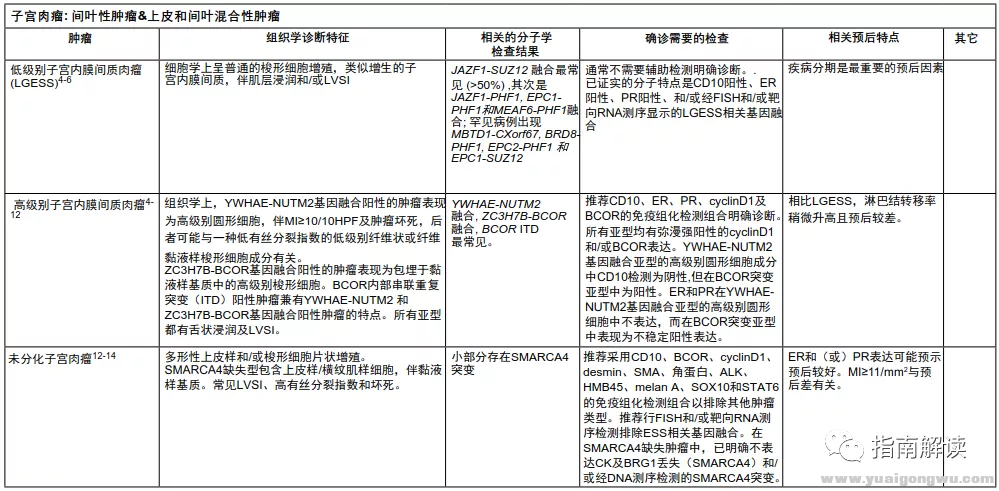
UTSARC-A,4/5
表1(续)
UTSARC-A,5/5
参考文献
________________________________________
影像学检查原则a,1-9(UTSARC-B)
UTSARC-B,1/2
影像学检查原则
初始检查
●胸部/腹部/盆腔 CT。
●对于接受全子宫切除术中偶然发现子宫肉瘤或子宫/附件未完全切除(如次全子宫切除术[SCH]、肌瘤剔除术、可能存在肿瘤破碎、腹膜内分碎术)的患者,行胸部/腹部/盆腔CT或腹部/盆腔MRI和胸部CT平扫以评估远处转移。
●考虑行盆腔MRI以评估局部肿瘤的范围或在子宫或附件未切除或未完全切除(如次全子宫切除术、肌瘤剔除术、可能的肿瘤破碎、腹膜内分碎术)的病例中评估残留病变。
●考虑行全身 PET/CT 检查以明确存有疑义的发现。
●附加的影像学检查应基于各种症候学和临床上对远处转移的担心情况。b
随访/监测
●在前3年,每3-6个月行一次胸部/腹部/盆腔 CT;第4-5年,每6-12个月复查一次;再往后的5年,根据组织学分级和初始分期,考虑每年复查1-2次影像学检查。c
●前3年,每3-6个月选择性行一次腹部/盆腔MRI和胸部CT 检查平扫;第4-5年,每6-12个月复查一次。再往后的5年,根据组织学、肿瘤的分级和初始分期,考虑每年复查1-2次影像学检查。c
●对于一些疑似存在转移的选择性患者,考虑行全身PET/CT检查。
●影像学检查应基于症候学和临床上对远处转移的担心情况。d
脚注:
a.除非存在禁忌症,指南中提及的MRI和CT都要加增强扫描。筛查性胸部CT不需要加增强扫描。
b.指征可能包括体检发现异常、巨块性子宫肿瘤、阴道或宫外受侵、发现或治疗晚、存在腹部或肺部症状。
c.随访的影像学检查可以每3个月复查一次或者根据肿瘤的组织学分级和/或分期调整。
d.指征可能包括体检发现异常(如发现阴道肿瘤)、触及肿块或增大的淋巴结、新发的盆腔、腹部或肺部症状。
UTSARC-B,2/2
参考文献
________________________________________
子宫肉瘤的系统性治疗(UTSARC-C)
脚注:
1.见《NCCN卵巢癌指南》中的“药物反应处理”章节(OV-D)。
2.帕唑帕尼、替莫唑胺、艾日布林、拉罗替尼和恩曲替尼可考虑用于先前接受细胞毒性化疗中复发或转移的患者。
3.用于先前接受过含蒽环类药物方案治疗的子宫平滑肌肉瘤者。
4.这些激素治疗可考虑用于 ER/PR 阳性的子宫平滑肌肉瘤(uLMS)患者,首选用于小体积的肿瘤或生长缓慢的肿瘤。
________________________________________
子宫肿瘤的放疗原则(UN-A)
UN-A,1/2
一般原则
子宫肿瘤放疗的一般原则:
●放疗的靶区包括已知或疑似肿瘤侵犯的部位,可能行外照射放疗(EBRT)和/或近距离治疗。在实施放疗前,需要通过影像学检查来评估局部区域的范围和排除远处转移。一般来说,外照射放疗的靶区包括盆腔加或不加腹主动脉旁区域。近距离放疗可以施用于:
1)完整子宫的术前放疗或根治性放疗;或
2)更常用于子宫切除术后阴道的照射。根据这些指导原则的意见,全腹放疗不视为靶向肿瘤的放疗。
UN-A,2/2
一般治疗信息和剂量处方方案
一般治疗信息
●靶区
►盆腔放疗的靶区应包括肉眼可见的病灶(如果存在)、髂总下部、髂外、髂内、闭孔、宫旁、阴道上部/阴道旁组织、和骶前淋巴结(宫颈受侵的患者)。
►扩大照射野应包括盆腔区和包括整个髂总淋巴链和腹主动脉旁淋巴结区。扩大野的上界取决于临床状况,但应至少到达肾血管上方1-2cm。
►存在风险的盆腔组织,尤其是在子宫切除术后,可因肠管和膀胱的充盈情况而有很大的变化。在这种情况下,包含器官运动和变形范围的综合靶区(ITV)被视为是临床靶区(CTV),应完全覆盖治疗区。
●剂量处方方案——外放疗
►镜下病灶的外放疗照射剂量应达到45-50 Gy。应使用基于CT治疗计划的多适形野技术,为了隔离保护正常组织,可考虑采用IMRT,并酌情注意QA和组织间隙的活动。如果术后残留肉眼可见的病灶并且该区域可以被充分定位,在正常组织可以耐受的前提下可以推量照射至总剂量达60-70Gy。
►新辅助放疗通常采用45-50Gy的剂量。可以考虑在总剂量等效于75-80Gy低剂量率照射的方案中插入1-2次高剂量率(HDR),以尽可能降低子宫切除术切缘阳性或近缘过近的风险。
●剂量处方方案——近距离治疗
►阴道切口一旦愈合即应开始行近距离放疗,首选在术后6-8周开始施行,一般近距离治疗开始的时间不应超过术后12周。经阴道近距离放疗,照射剂量应递送至阴道表面或是阴道表面下方0.5cm;剂量取决于外照射放疗的使用。子宫切除术后经阴道近距离放疗的靶区不应超过阴道上2/3;对于存在广泛淋巴脉管浸润或切缘阳性的病例,阴道照射的靶区可能更长。
◊术后单纯高剂量率(HDR)经阴道近距离放疗,方案包括:6 Gy×5 f照射阴道表面,或7 Gy×3 f或5.5 Gy×4 f照射至阴道表面下方0.5cm。7 Gy×3 f照射阴道表面下方0.5cm是被许多医生采纳的方案,在一些选择性病例中,使用较小的分割剂量可能进一步减少毒性。
◊当高剂量率(HDR)经阴道近距离放疗用作外放疗推量照射时,常采用4-6 Gy×2-3 f照射阴道粘膜。
►对于因全身状况无法耐受手术的子宫恶性肿瘤患者,宫外扩散的风险决定选择联合行“联合外放疗+近距离放疗”或单纯行“近距离放疗”。用于根治性治疗的近距离放射治疗剂量应基于临床情况个体化。如果条件许可,应使用图像引导下治疗。基于现有的最佳证据,如果单独使用近距离放射治疗,应将至少48Gy的EQD2 D90递送至子宫、宫颈和阴道上部1-2cm,如果联合使用“EBRT+近距离放疗”,剂量应增加至65Gy。 如果MRI用作治疗计划的一部分,则GTV的靶区剂量将是≥80Gy的EQD2。
________________________________________
分期(ST-1)
ST-1
子宫癌的分期
ST-2
子宫癌的分期(续)
ST-3
子宫肉瘤的分期
|